Introducción
El neonato con una infección adquirida transplacentariamente durante el embarazo es portador de una infección congénita, que potencialmente puede ocasionar aborto, óbito fetal, restricción del crecimiento intrauterino o una infección asintomática que se puede convertir en un proceso posnatal crónico1.
En 1971, Andreas Nahmias2 definió que tales infecciones se agrupan bajo el acrónimo TORCH (toxoplasmosis, otros agentes, rubéola, citomegalovirus (CMV) y virus del herpes simple (VHS)3-5) (tabla 1), que se utiliza universalmente para caracterizar el cuadro clínico que padece el feto o recién nacido (RN) y que es compatible con una infección congénita producida por estos microorganismos6.
Tabla 1 Microorganismos que están considerados dentro de las infecciones torch. fuente: miranda-barrios j, sánchez-garcía l, pellicer-martínez a. infecciones congénitas (torch y parvovirus b19). pediatr integral. 2023;xxvii(7):364-73.

Una de las principales causas del embarazo de alto riesgo es este conjunto de infecciones maternas, que a menudo pasan inadvertidas si no se les busca activamente. Es vital el diagnóstico temprano de la enfermedad materna y la monitorización fetal una vez reconocida la enfermedad7,8. La gravedad de estas infecciones depende de la semana de gestación, el estado inmunológico de la gestante y la virulencia del agente infeccioso9. Su seroprevalencia en mujeres embarazadas puede variar ampliamente en diferentes partes del mundo6,10.En el Perú no existen estudios multicéntricos, solo algunas investigaciones circunscritas11-14 que no dan una idea de la incidencia y prevalencia nacional de estas infecciones. Tampoco existe una norma técnica sanitaria que exija el diagnóstico precoz. Por lo que un número indeterminado de gestantes no son diagnosticadas, al igual que la etiología de los óbitos fetales y la morbilidad de los RN relacionados con tales patologías.
Existe evidencia que en ciertos países de América Latina alguna de las infecciones TORCH están presentes de manera significativa15-21, por ello han diseñado protocolos específicos7,16,18.
Ensayos de laboratorio clínico
Estas infecciones no se pueden diagnosticar solo mediante la clínica. Requieren de diversos ensayos de laboratorio para su identificación y estimación del peligro. Los de uso más frecuente son el enzimoinmunoanálisis de adsorción (ELISA) y la quimioluminiscencia. También se utilizan, en determinadas circunstancias, la reacción en cadena de la polimerasa (PCR), ensayos de inmunofluorescencia e inmunoblot10. En los últimos años se introdujeron las pruebas rápidas, siendo el método más empleado la cromatografía, que detecta cualitativamente las inmunoglobulinas M y G (IgM e IgG) específicas contra estos microorganismos. Vista la gran variedad de los procedimientos de laboratorio, es importante el conocimiento preciso de su interpretación y su validación por un centro de referencia7 -control de calidad externo-.
Las diversas patologías que componen el TORCH presentan peculiaridades con respecto a la solicitud e interpretación de los ensayos de laboratorio. Sin embargo, de manera genérica puede ser útil el algoritmo que se presenta en la figura 1, que corresponde al tamizaje de las gestantes, a las cuales se solicita de inicio la detección de la IgM e IgG.
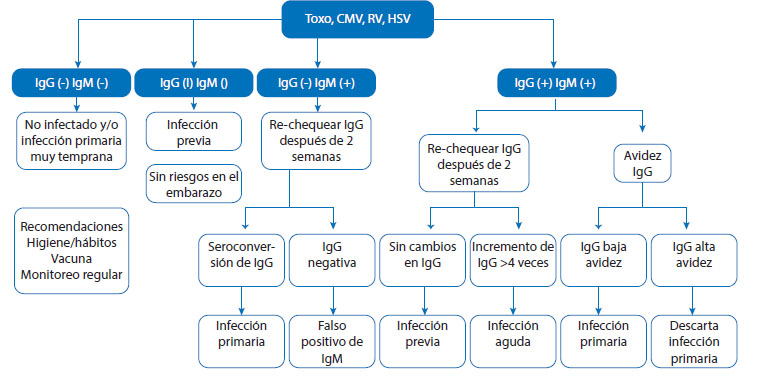
Figura 1 algoritmo para la detección en gestantes de la infección por los microorganismos que componen el torch. fuente: la importancia de la detección de torch en el embarazo. wiener laboratorios saic, buenos aires, argentina. publicado el 31 de octubre de 2023. disponible en: https://www.wiener-lab.com/es-pe/new/173/
Con relación a los neonatos, en general es importante la detección de la IgM e IgA para establecer la presencia de una infección aguda activa, con todos los riesgos que eso implica7. No obstante, el diagnóstico definitivo depende además de la evolución de la IgM, de ciertos ensayos microbiológicos y de biología molecular y estudios ecográficos, cuyo pedido e interpretación difieren según cada microorganismo, tal como se detalla más adelante7.
1. Toxoplasma
El Toxoplasma gondii, un parásito protozoario intracelular, es el agente etiológico de la zoonosis más común del orbe7, que se propaga mediante alimentos o agua infectados y carne poco cocida8. Puede infestar a todos los animales de sangre caliente, incluyendo al ser humano7. Se conjetura que su seroprevalencia es de alrededor del 30%23), ocurriendo 1 infección congénita por cada 1,000 nacimientos, aunque ello es variable, dependiendo de la edad de la gestante, ubicación geográfica, condiciones higiénicas, hábitos de vida, estado nutricional y el contacto con ciertos animales, en particular los gatos7.
El feto se infecta durante la fase de parasitemia materna, que solo sucede en la infección primaria24. El peligro y la magnitud de la infección congénita es dependiente del momento de la gestación en que se desarrolla la enfermedad. La tasa de transmisión vertical en los primeros tres meses es de 7%, aumenta hasta 24% en el segundo trimestre y fluctúa entre el 60% y 81% en los tres últimos meses23. La secuela de la infección aguda fetal es casi inexistente cuando ocurre 3 meses o más antes de la concepción9. La interacción del T. gondii con la barrera placentaria aún no se conoce perfectamente23.
1.1. Ensayos diagnósticos en la gestante
La infección materna se diagnostica inicialmente a través del ELISA y la inmunofluorescencia (ELFA), las cuales detectan las IgM e IgG específicas25. Ambas evidencian en el embarazo la seroconversión o el incremento de tres veces o más de la IgG, entre dos muestras tomadas con intervalos de 2 a 4 semanas24,26.
La IgM aparece primero, usualmente luego de 1 semana de la infección, el titulo aumenta hasta 1 a 3 meses, luego disminuye y se torna negativo después de los 9 meses, llegando a la negativización7. La tasa de disminución es variable25. Menos de un tercio de la población muestra títulos sostenidos de IgM por 2 o más años7. En consecuencia, su hallazgo en la gestante no siempre supone una infección aguda7. Para ello hay que realizar la prueba de avidez de IgG y la determinación de IgA, o extraer otra muestra para la detección de la IgG luego de trascurrir 2 a 4 semanas, para advertir si suceden marcadas diferencias en el título de anticuerpos, lo cual confirmaría una infección aguda7.
La cinética de la producción de IgA es semejante a la de IgM, alcanza un pico más tardío y subsiste de 6 a 7 meses después de la primera infección7. En ciertos casos dura más de 1 año o en unas pocas infecciones agudas es indetectable, por lo que debe analizarse en conjunto con las pruebas de avidez7. Las pruebas inmunológicas no son útiles para desestimar una infección al inicio del embarazo, cuando el diagnóstico sucede luego del tercer mes y no se dispone de una muestra tomada al principio de la gestación7.
La IgG comienza a detectarse desde las 2 semanas de infección7,25, alcanza su nivel máximo a los 3 meses y permanece estable durante 6 meses7. Después de 1 año comienza a disminuir lentamente hasta alcanzar su nivel más bajo que persiste toda la vida7,25, a causa de la permanencia de los quistes latentes en el infectado7. Los niveles altos de IgG después del quinto mes de embarazo se relacionan con la memoria inmunológica27.
La ausencia de IgG no excluye plenamente el diagnóstico en gestantes inmunocomprometidas, donde el cuadro se muestra como la reactivación de una infección latente25.
El tamizaje sistemático de IgG se debe realizar en todas las gestantes durante los primeros tres meses y, si es negativo, se deben tomar medidas preventivas primarias7. Un resultado positivo puede deberse a una infección anterior al embarazo, que se corrobora cuando la IgM es negativa, lo que significa que no existe riesgo de infección fetal7.
Las pruebas de avidez de IgG ayudan a discriminar una infección reciente28, documentan el tiempo de evolución en una sola muestra, aunque tampoco aportan resultados definitivos26,28. Tales ensayos están basados en la medida de la fuerza o afinidad de la unión del complejo antígeno-anticuerpo. En los primeros meses de la infección se produce IgG de baja afinidad, la cual aumenta con el tiempo; pero esa progresión puede ser modificada mediante la aplicación del tratamiento específico29.
Durante el ensayo se expone el complejo antígeno-anticuerpo a reactivos que disocian la IgG específica del Toxoplasma gondii de su antígeno25,29. Tres factores determinan la estabilidad de este complejo: la afinidad anticuerpo-epítope, las valencias de ambos componentes y el orden estructural de las fracciones que interaccionan30. Estas pruebas se suelen llevar a cabo mediante el método de ELISA30.
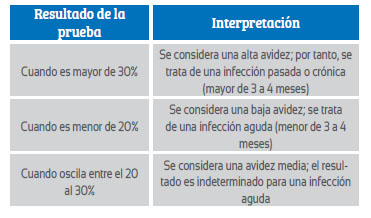
Las IgG de alta avidez aparecen entre 12 y 16 semanas después de la infección7. Su presencia en los tres primeros meses de embarazo indica que se produjo antes del mismo y no hay peligro para el feto7. La interpretación de las pruebas de avidez de la IgG depende del reactivo utilizado, el cual debe incluir obligatoriamente la información sobre los criterios específicos correspondientes. Ramírez-Barrios y colaboradores proponen la interpretación que se aprecia en la tabla 2 26.
Tabla 2 Interpretación de la prueba de avidez de la igg en la infección por el toxoplasma gondii. fuente: miranda-barrios j, sánchez-garcía l, pellicer-martínez a. infecciones congénitas (torch y parvovirus b19). pediatr integral. 2023;xxvii7):364-73.
El diagnóstico prenatal de infección fetal es obligatorio cuando los resultados serológicos en la gestante indican infección inmediatamente anterior o durante el embarazo o cuando hay certidumbre ecográfica de infección fetal7.
1.2. Ensayos diagnósticos perinatales
El diagnóstico de infección fetal se sustenta en la tipificación del microorganismo y/o la respuesta inmune específica7. Se ha demostrado que la replicación de una secuencia propia del ácido desoxirribonucleico (ADN) mediante la PCR en el líquido amniótico (LA), desde la semana 18 de embarazo, es más rápida y segura que otros métodos7,28,31. Su sensibilidad, especificidad y valor predictor positivo son del 100%20). No obstante, un resultado negativo no excluye la infección7. La amniocentesis se llevará a cabo luego de 4 semanas de la fecha estimada en que se produjo la infección aguda gestacional7,31. En el RN los criterios serológicos diagnósticos de la toxoplasmosis congénita (TC) son16:
Permanencia de la IgG después del primer año de edad.
IgG e IgM y/o IgA positivos.
PCR positiva en LA, sangre, líquido cefalorraquídeo (LCR) y orina.
Anticuerpos neonatales IgG positivos e IgM e IgA negativos con evidencia serológica de infección materna aguda durante el embarazo y presencia de manifestaciones clínicas sugestivas de TC.
Hasta el 70% de los neonatos infectados en los primeros tres meses del embarazo pueden no tener IgM e IgA delectable en sangre, por lo que se les debe monitorear serológicamente durante 12 meses7. La ausencia de IgG en esa etapa de la vida excluye la infección7. Después del parto se puede realizar la PCR en la placenta, que tiene una especificidad de 97%, aunque solo significa la infección de este órgano, no necesariamente del RN7. El análisis anatomopatológico de la placenta es poco sensible y no se recomienda7.
Cuando no se encuentran IgA o IgM específicas, la PCR en sangre, orina y LCR del RN se puede utilizar como complemento diagnóstico al estudio serológico7. Poseen una adecuada especificidad y baja sensibilidad7. Un resultado positivo corrobora la infección, pero uno negativo no la elimina y necesita de un rastreo serológico7,31.
2. Rubeola
La rubéola se transmite de persona a persona y durante el embarazo mediante la transferencia placentaria8; el único reservorio conocido es el hombre. Es una infección leve o asintomática en niños y adultos, pero al atravesar la placenta puede causar aborto espontáneo, muerte fetal o patologías congénitas graves, incluyendo discapacidad auditiva, cataratas y defectos cardíacos, que en conjunto se conocen como el síndrome de rubéola congénita8. La Organización Mundial de la Salud (OMS) impulsa programas de vacunación global9. Sin embargo, en ciertos países la seropositividad continúa elevada9.
2.1. Ensayos diagnósticos en la gestante
Se debe realizar el examen serológico de IgM e IgG en la gestante30. La primera resulta positiva 1 a 3 días después de la aparición del exantema y subsiste entre 2 y 3 meses30. La IgG se presenta desde la segunda semana después del exantema7. Su título máximo cambia de persona a persona, uno alto de IgG no es un marcador seguro de infección primaria actual; la ausencia de lgA puede ayudar a excluirla30.
Si las IgM e IgG son negativas, se requiere una segunda muestra tres semanas después del contagio7. Cuando el estudio se lleva a cabo luego de dos semanas de la aparición del exantema, se recomienda complementarlo con la prueba de avidez de la IgG7.
El diagnóstico se sustenta en el incremento significativo de la IgG en dos muestras de sangre extraídas en un lapso de 2 a 3 semanas7, que se hace concluyente cuando el aumento es 4 veces el título inicial32. Los estudios deben comprender el aspirado nasofaríngeo (ANF) para el aislamiento y genotipado del virus32, que se procesará solo cuando se confirma mediante serología7.
Las lgG producidas en la infección primaria poseen una avidez débil. Aquellas sintetizadas más de 3 meses después tienen una alta avidez que únicamente se consigue luego que el clon de linfocitos B, productor de estos anticuerpos, ha sido escogido como su productor. Esta selección empieza luego de 6 a 10 semanas de la infección. Una avidez inferior al 25% señala que los anticuerpos tienen una antigüedad no mayor de tres meses30.
Después de la vacunación, cambia la cinética de los anticuerpos30. Los títulos de IgM permanecen por años usualmente bajos y constantes, lo que no ocurre en la infección natural30. Luego de la vacunación, la avidez se produce con mayor lentitud respecto a la referida infección30.
2.2. Ensayos diagnósticos perinatales
La infección fetal intrauterina se confirma mediante:
El hallazgo de IgM en sangre del feto, cuya mayor sensibilidad ocurre luego de la semana 2226 o por la evidencia de IgG persistente entre los 6 y 12 meses de vida7. Cuando resulta positiva la IgM fetal, se tomará, luego del parto, una muestra de suero materno, para el estudio de IgG7.
La detección del virus en las vellosidades coriónicas26.
La detección del ácido ribonucleico (ARN) viral mediante la técnica de la PCR en el LA24,26.
Además se pueden llevar a cabo la PCR en el ANF, orina, líquido céfalo raquídeo (LCR) y sangre hasta los 12 meses de vida7.
3. Citomegalovirus (CMV)
Los humanos son los huéspedes reservorios del CMV y se contagian, como sucede con las gestantes, por contacto directo con la saliva, orina y secreciones genitales de sujetos infectados8. El estatus socioeconómico, las circunstancias de vida, los hábitos culturales y nutricionales y las condiciones higiénicas son factores predisponentes en la seropositividad para el CMV9.
La tasa de transmisión vertical es inferior al 1%. No se recomienda el tratamiento antiviral en embarazadas, principalmente porque no existe ningún fármaco que pueda reducir la transmisión al feto9.
3.1. Ensayos diagnósticos en la gestante
Debido a la carencia de una terapia eficaz para prevenir la infección congénita, no existe unanimidad sobre el tamizaje universal para la detección del CMV durante el embarazo7,26. Inclusive, en ciertas naciones se ofrece el aborto terapéutico cuando se evidencia la infección7. La detección de anticuerpos se realiza principalmente mediante ELISA33, siendo la seroconversión la forma más confiable para diagnosticar la infección primaria en el embarazo30.
La IgM se encuentra en menos del 30% de las mujeres con infección primaria7 y su valor predictivo positivo varía entre 15% y 40%, según la detección sea general o dirigida34. Se halla luego de 2 semanas del principio de la sintomatología33 y permanece hasta 12 meses posteriores a la infección primaria7, lo que imposibilita aseverar que su detección sea sinónimo de infección primaria reciente30, pudiendo significar33:
Infección reciente,
Reactivación de una infección adquirida en el pasado,
Falso positivo.
La detección de IgG puede indicar una exposición anterior a la gestación, la reinfección con una cepa diferente de CMV o la reactivación del virus latente en el trascurso del embarazo7.
El ensayo de avidez de IgG ayuda a reconocer la infección primaria en gestantes7. En tal caso, los anticuerpos son de baja avidez, lo que indica una infección adquirida en los últimos 3 a 4 meses; la IgG de alta avidez solo se encuentra después de 2 a 4 meses33. Este ensayo, usualmente efectuado mediante ELISA, tiene el mismo sustento teórico que el descrito para la infección por el Toxoplasma gondii y su interpretación depende del reactivo empleado, por lo cual cada inserto debe incorporar los criterios específicos correspondientes. Gonzales-García y colaboradores35 proponen los valores que se aprecian en la tabla 3. Esta prueba de avidez debe ser incorporada en los algoritmos para el tamizaje de las gestantes 35.
Tabla 3 interpretación de la prueba de avidez de la igg en la infección por el citomegalovirus (cmv). fuente: gonzales-garcía c, reyes-méndez m, ortega-pierres l, rodrí-guez-sánchez a, sandoval-guido v, sereno-colo j. seroprevalencia y detección de infección primaria por citomegalovirus mediante prueba de avidez igg en el primer trimestre de embarazo. salud pública de méxico. 2014;56(6):619-24.

Aunque estos ensayos no son adecuados para detectar infecciones en gestantes inmunocomprometidas, los niveles de IgG guían su manejo cuando existe riesgo de reactivación de la infección33.
3.2. Ensayos diagnósticos perinatales
Desde las semanas 19 y 20, el feto empieza a excretar orina al LA7. Para realizar las pruebas diagnósticas deben trascurrir por lo menos 7 semanas desde la presumible infección materna7,26. Se aconseja llevar a cabo la amniocentesis a partir de la semana 21 de gestación7,26, siendo el procedimiento preferente la detección del ADN viral a través de la PCR, debido a su alta sensibilidad (90-98%) y especificidad (92-98%) 7,26. Esto debe complementarse con el seguimiento ecográfico seriado, en búsqueda de evidencias de infección fetal7.
La detección del CMV en el RN igualmente se puede efectuar mediante cultivos celulares acelerados -técnica de shell vial-, a partir de especímenes de orina y saliva, que contienen concentraciones altas y constantes7). Las muestras se toman en las primeras 2 o 3 semanas de vida, ya que la excreción del virus puede reflejar una infección adquirida después del parto -canal del parto o leche materna-(7.
En vista que la viremia es variable, la PCR en sangre puede presentar, con mayor frecuencia, falsos negativos26. En muestras de orina26 o saliva líquida y seca, este procedimiento presenta una sensibilidad superior al 97% y una especificidad de 99,9% en comparación con el cultivo en saliva y orina7 y debe realizarse hasta las 3 semanas de vida23.
4. Virus herpes simple (VHS)
Existen dos serotipos de VHS que producen la enfermedad viral de transmisión sexual más frecuente en el mundo8. El tipo 1 (VHS-1) se transmite generalmente por vía no sexual en el trascurso de la infancia, mientras que el tipo 2 (VHS-2) lo hace siempre por vía sexual y es la principal causa del herpes genital8. La infección permanece asintomática en más del 75% de los casos genitales primarios. Sin embargo, en los RN es una causa significativa de morbilidad y mortalidad, pudiendo causar aborto espontáneo, prematuridad o herpes congénito8.
La incidencia estimada de la infección neonatal es muy variable, oscila entre 3 y 30 x 100,000 nacidos vivos. Se cree que es responsable global de hasta el 3% de las infecciones en embarazadas23. La epidemiología y la expresión clínica han cambiado. El VHS-1 ha sobrepasado al VHS-2 como el agente viral más frecuente en la infección neonatal, lo que concuerda con la mayor afectación cutánea en comparación con épocas anteriores en las que prevalecía la semiología asociada al sistema nervioso central (SNC) o la forma diseminada26. Gran parte de las afecciones neonatales suceden cuando la infección primaria en la gestante ocurre al final del embarazo, cerca del parto y antes que la IgG materna aumente lo suficiente para proteger al feto23.
4.1. Ensayos diagnósticos en la gestante
Los ensayos serológicos no son usualmente aconsejables en el diagnóstico de las infecciones maternas7. Con frecuencia ocurren reacciones cruzadas entre el VHS-1 y VHS-2, la IgM aparece tardíamente y la persistencia de la IgG por más de 6 a 12 meses puede corroborar la infección24. Estos ensayos solo se emplean cuando las pruebas microbiológicas son negativas y existe una alta sospecha de la infección26, siendo la técnica de ELISA la utilizada con mayor frecuencia, detectando las IgM e IgG. Solo la seroconversión permite hacer el diagnóstico de la primoinfección materna. De ahí la necesidad de disponer de dos sueros con dos o tres semanas de intervalo36.
4.2. Ensayos diagnósticos perinatales
El cultivo viral es el método más confiable para el diagnóstico de la infección neonatal24. No obstante, la detección del ADN viral mediante la PCR es una técnica admisible y utilizada con frecuencia24. Antes de principiar el tratamiento del neonato con presunta infección, es recomendable hacer un hisopado de la cavidad oral, nasofaringe, conjuntiva y ano, y tomar muestras de las vesículas cutáneas, LCR y sangre, con el fin de procesar la PCR7.
A causa que el aumento de la alanina aminotransferasa (ALT) está relacionado con una mayor tasa de mortalidad, se recomienda realizar su medición7. La PCR en el LCR es el estándar de oro para el diagnóstico de encefalitis por VHS. Sin embargo, hay que tener en cuenta que durante los primeros tres días el rendimiento solo alcanza el 70% y aumenta hasta el 100% si la muestra se obtiene entre el tercer y el quinto día de evolución7. Es aconsejable volver a ejecutar el ensayo si resultó negativo durante los primeros tres días7.
La PCR en sangre puede ser eficaz para diagnosticar la infección neonatal, particularmente cuando no hay lesiones cutáneas7. Con independencia de su clasificación clínica, la muestra es positiva en la mayoría de RN infectados7. En consecuencia, no debe emplearse para establecer la gravedad de la enfermedad o la duración adecuada del tratamiento7.
La positividad de la PCR en sangre puede perdurar durante todo el curso de la terapia antiviral. No se conoce con certeza su significado clínico7. Hoy en día, no se aconsejan los PCR en serie para monitorear la respuesta a la terapia7.
Comments (0)